Contexte et objectif - Loi de Boyle-Mariotte
On considère un volume V de gaz, à la pression P et à la température T maintenue constante.
Qualitativement, on constate que la diminution du volume entraîne une augmentation de la pression et inversement. Le modèle microscopique des fluides permet d'interpréter simplement ce phénomène avec l'augmentation de la fréquence des chocs sur les parois si le volume diminue.
Il s'agit dans cette partie d'établir une relation mathématique entre pression et volume, à température constante. Cette relation constitue la loi de Boyle-Mariotte.
Méthode : Expérience et prise de mesures
On relie une seringue à un capteur de pression connecté à un micro contrôleur permettant l'affichage de la pression en hectopascal (hPa).
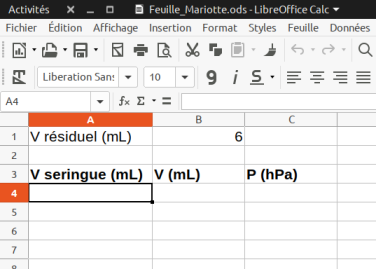
Le volume de gaz résiduel dans l'embout de la seringue et dans le tuyau est estimé à \(6\ \mathrm {mL}\).
Les mesures devront être consignées dans la feuille de calcul Libreoffice à télécharger.
Ci-dessous, la vidéo de l'intégralité de la prise de mesures.
Ouvrir la feuille de calcul permettant de consigner les mesures.
Réaliser les mesures décrites dans la vidéo de l'expérience et les consigner dans le tableur.
Exploitation des mesures sur le tableur
Question⚓
Dans la feuille de calcul partiellement complétée, entrer la formule permettant de calculer le volume total V du gaz.
En traçant la représentation graphique de la pression en fonction du volume de gaz (XY Dispersion), répondez aux questions suivantes :
la relation entre pression et volume est-elle de type linéaire ou affine ?
tester d'autres modèles de courbes de tendance pour trouver celle dont l'accord avec l'expérience est le meilleur.
Une fois la modélisation adéquate établie, répondez aux questions suivantes :
quelle particularité présente le produit \(P \times V\) d'après l'équation de la courbe de tendance ?
ajouter une colonne dans la feuille de calcul permettant de calculer ce produit. Cela confirme-t-il la réponse précédente ?
Solution⚓
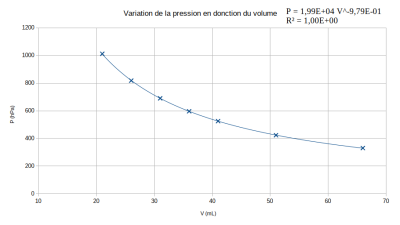
2. La représentation graphique \(P=f(V)\) montre clairement que la relation mathématique n'est ni de type linéaire, ni de type affine. Les points de mesure ne sont pas répartis sur une droite.
Le modèle le plus satisfaisant est la modélisation de type puissance.
L'équation donnée par le tableur est :
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger la vidéo.
3. La modélisation obtenue avec le tableur peut être exprimée avec une puissance entière :
La pression P est donc inversement proportionnelle au volume V.
Dans ces condition, le produit \(\mathbf {P \times V}\) est constant.
La dernière colonne ajoutée dans la feuille de calcul confirme de manière satisfaisante cette remarque.
On peut remarquer que les résultats dépendent de manière sensible de l'estimation du volume résiduel (changer la valeur dans le tableur pour le constater). La mesure du volume sur la seringue est par ailleurs peu précise, ce qui explique qu'on n'obtient pas exactement la relation attendue.
On retiendra qu'à température constante, le produit de la pression par le volume est constant : \(P \times V = cste\). Cela constitue la loi de Boyle-Mariotte.
Retour sur la problématique initiale - Application à l'apnéiste
Question⚓
Lors de la plongée, la pression à la surface de l'eau est égale à la pression atmosphérique. Ce jour là, \(P_{\mathrm{atm}}=1018\ \mathrm {hPa}\).
Le plongeur prend une inspiration complète en surface avant de descendre. Son volume pulmonaire est \(V_{\mathrm{poumons}}=2{,}5\ \mathrm L\).
Il descend à la profondeur de 10 mètres, quel volume occupe alors le gaz ?
Quel problème se pose-t-il s'il remplit à nouveau ses poumons sur une bouteille munie d'un détendeur lors de la remontée ?
Solution⚓
1. Lors de l'activité précédente, on a déterminé la pression qui règne à 10 mètres de profondeur : \(P(10)=2023\ \mathrm{hPa}\). On note \(V(10)\) le volume pulmonaire à la profondeur de 10 mètres.
D'après la loi de Boyle-Mariotte appliquée au volume d'air inspiré dans les poumons, le produit de la pression par le volume est constant.
Donc :
Application numérique :
\(V(10)=\dfrac{1018 \times 2{,}5}{2023} \simeq1{,}3\ \mathrm L\)
À la profondeur de 10 mètres, le volume occupé par l'air est donc environ deux fois plus faible qu'à la surface.
2. Si l'apnéiste remplit ses poumons au détendeur d'une bouteille d'air comprimé, il inspire \(2{,}5\ \mathrm L\) à la pression \(P(10) = 2023\ \mathrm {hPa}\).
S'il remonte à la surface, la pression diminue quasiment d'un facteur 2, donc le volume de gaz augmente de ce même facteur et passe à près de 5 litres. Ce volume dépasse largement la capacité pulmonaire, il y a donc risque de lésions graves des poumons.
Ce problème ne se pose pas avec une inspiration en surface, une descente puis une remontée puisque les poumons reprennent leur volume initial.
En plongée avec des bouteilles d'air comprimé, il est de toutes façon impératif d'expulser de l'air lors de la remontée qui doit de toutes façons être lente. Une remontée brusque, respiration bloquée, expose au même traumatisme pulmonaire.