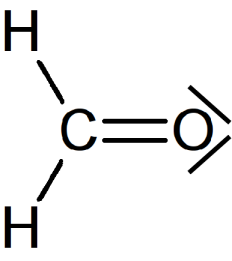Définition : Liaison covalente
Une liaison covalente est le type de liaison que forment deux atomes voisins dans une molécule. Elle résulte de la mise en commun de deux électrons apportés par chacun des atomes. Une liaison covalente peut être simple, double ou triple.
Rappel : Structure électronique et électrons - Électrons de valence
Le nombre d'électrons de valence (ou périphériques, ou encore externes) est déterminé à partir de la structure électronique de l'atome.
Le document disponible ICI rappelle les règles de remplissage des couches et sous-couches électroniques d'un atome.
Considérons par exemple l'azote, de symbole N et de numéro atomique \(Z=7\). Il possède donc au total 7 électrons.
En suivant les règles de remplissage des couches et sous-couches, on obtient la configuration électronique de l'atome d'azote :
\(_7 N\) : \(1s^22s^22p^3\)
Les électrons externes peuplent la couche de nombre quantique principal le plus élevé.
Dans le cas de l'azote, il s'agit de la couche L de nombre quantique \(n=2\) : \(1s^2\mathbf{2}s^2\mathbf{2}p^3\).
L'atome d'azote possède donc 5 électrons de valence.
Définition : Valence d'un atome
La valence d’un élément chimique est le nombre de liaisons covalentes que l’atome forme avec les atomes voisins.
Définition : Configurations particulièrement stables
Le critère de stabilité retenu est la règle de l'octet (ou du duet pour l'élément hydrogène) qui stipule qu'une structure électronique externe comportant 8 électrons (2 dans le cas du duet) est particulièrement stable. C'est ce principe qui permet de prévoir la formule des ions monoatomiques courants (voir programme de 2nde ).
Ainsi, dans les configurations particulièrement stables courantes, un atome a tendance à former autant de liaisons covalentes que nécessaire avec ses voisins pour s'entourer de 8 électrons périphériques.
L'élément hydrogène fait exception, sa valence est toujours égale à 1.
Définition : Représentation de Lewis d'une molécule
La représentation de Lewis d'une molécule donne l'ensemble de la structure électronique externe des atomes qui entrent dans la composition de la molécule.
En première, cela revient à faire figurer les doublets de liaison entre les atomes et des doublets non-liants localisés sur des atomes spécifiques. On rappelle qu'un doublet est constitué de deux électrons.
On ne traite ici que des molécules où les atomes respectent la règle de l'octet même s'il existe des exceptions.
Ci-contre la formule de Lewis de la molécule d'eau sur laquelle on a fait figurer :
en rouge les doublets de liaison entre les atomes d'hydrogène et l'atome d'oxygène.
en bleu les doublets non liants localisés sur l'atome d'oxygène.

Méthode : Établir la représentation de Lewis d'une molécule
Pour établir la formule de Lewis d'une molécule on doit s'assurer que les atomes respectent la règle de l'octet : chaque atome entrant dans la composition d'une molécule s'entoure de 8 électrons, soit 4 doublets (liants ou non liants).
L'atome d'hydrogène fait exception, il respecte la règle du duet (structure stable avec un doublet d'électrons) et ne forme qu'une liaison covalente.
Considérons la molécule d'ammoniac de formule brute NH3.
On commence par déterminer le nombre d'électrons de valence de chaque atome afin d'en déduire leur valence puis le nombre de doublets nd à répartir sur la molécule. la valence des atomes entrant dans la composition de la molécule.
Sans aucune indication directe, il faut établir la structure électronique des atomes.
Pour l'azote de numéro atomique \(Z=7\), on a la structure électronique suivante : \(1s^22s^22p^3\). L'atome d'azote possède donc 5 électrons de valence.
Un atome d'azote forme donc 3 liaisons covalentes pour respecter la règle de l'octet.
Pour l'hydrogène, la structure électronique est \(1s^1\). Chaque atome apporte donc 1 électron externe sur la molécule. La valence de l'hydrogène est quant à elle toujours égale à 1.
La molécule comporte donc un nombre d'électrons externes \(n_t=5+3\times 1=8\).
Soit un nombre de doublets : \(n_d = \dfrac{n_t}{2}=\dfrac{8}{2}=\mathbf 4\).
On peut à ce stade commencer à répartir les 4 doublets sur la molécule, d'abord en établissant des liaisons covalentes entre atomes en s'appuyant sur la règle de l'octet.
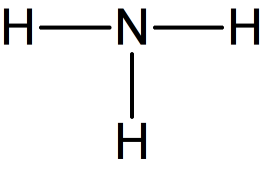
Liaisons covalentes dans la molécule d'ammoniac | Informations[*] La représentation de Lewis fait aussi apparaître les doublets non-liants localisés sur les atomes.
Il reste 1 doublet à répartir sur la molécule.
C'est l'application de la règle de l'octet qui permet de déterminer les atomes concernés par les doublets non-liants : chaque atome (autre que l'hydrogène) doit être entouré de 8 électrons.
Dans le cas de l'azote, les trois doublets de liaisons apportent 6 électrons. Il lui en manque donc 2, soit un doublet. Le doublet restant à répartir est donc localisé sur l'atome d'azote.

Formule de Lewis de la molécule d'ammoniac | Informations[*]
Formule de Lewis de la molécule de méthanal
Question⚓
La molécule de méthanal a pour formule brute CH2O.
Les numéros atomiques des atomes concernés sont :
C : \(Z=6\)
O : \(Z=8\)
H : \(Z=1\)
Établir la formule de Lewis de la molécule.
(La solution commentée est disponible ci-dessous).
Solution⚓
On commence par déterminer la valence des atomes entrant dans la composition de la molécule.
La structure électronique de l'atome de carbone est \(1s^22s^22p^2\). Il possède 4 électrons de valence, donc sa valence est \(v=8-4=4\).
La structure électronique de l'atome d'oxygène est \(1s^22s^22p^4\). Il possède 6 électrons de valence, donc sa valence est \(v=8-6=2\).
L'atome d'hydrogène a une valence égale à 1.
Le nombre d'électrons périphériques total sur la molécule est \(n_t=\underbrace {4}_{C}+\underbrace 6_O+\underbrace{2\times1}_{2\ H}=12\).
Soit un nombre de doublet à répartir sur la molécule : \(n_d = \dfrac{12}{2}=6\)
On établit les liaisons covalentes entre les atomes en respectant leur valence.
La seule configuration possible est la suivante, en utilisant 4 doublets de liaison.

Il reste à placer 2 doublets sur les atomes de façon à respecter la règle de l'octet.
L'atome de carbone est entouré de 4 doublets de liaison, donc de 8 électrons. Aucun doublet non-liant n'est nécessaire.
Pour l'atome d'oxygène, les deux doublets de liaison (liaison covalente double) lui apportent 4 électrons. Il lui en manque encore 4 pour respecter la règle de l'octet. Il possède donc 2 doublets non-liants.
La formule de Lewis de cette molécule est donc la suivante :