Règle de répartition des doublets autour d'un atome
On entend par géométrie d'une molécule la détermination de la répartition dans l'espace des liaisons autour des atomes et la conséquence de cette répartition sur la forme générale de la molécule.
La détermination de cette répartition passe par l'application du critère suivant :
Autour d'un atome, les doublets d'électrons liants et non-liants se répartissent dans l'espace de façon à s'éloigner au maximum les uns des autres.
Déterminer la géométrie d'une molécule revient à exploiter sa formule de Lewis pour faire l'inventaire des doublets à répartir en tenant compte de la règle de l'éloignement maximal.
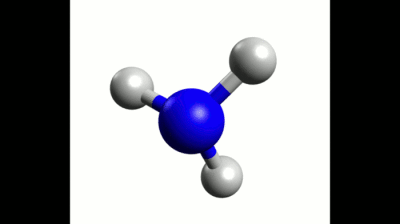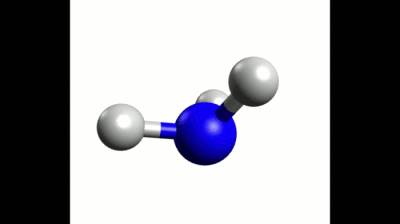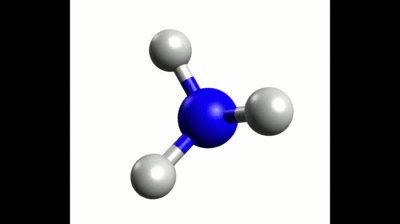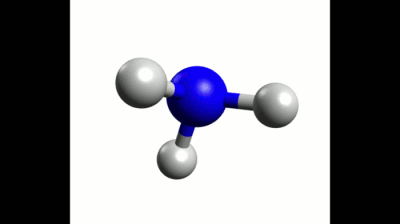
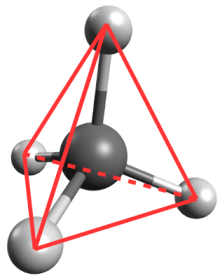
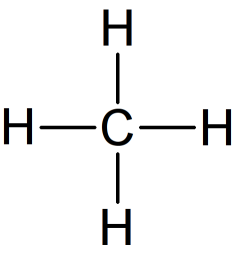
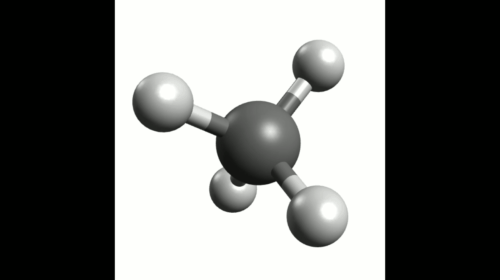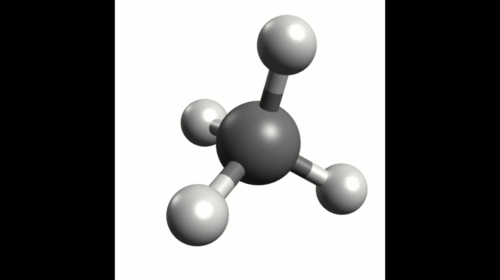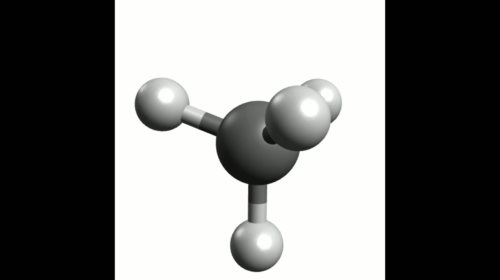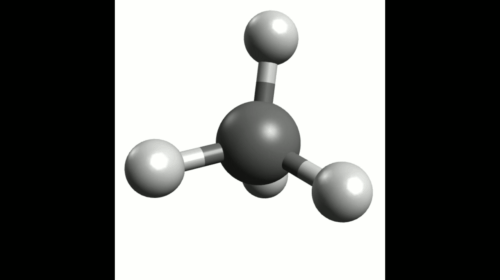
Exemple : Géométrie de la molécule de méthane
La représentation de Lewis de la molécule de méthane est donnée ci-contre.
Elle montre quatre doublets de liaison autour de l'atome de carbone et aucun doublet non-liant.
Ces quatre doublets se répartissent de façon à s'éloigner au maximum les uns des autres.
La configuration optimale correspond à des doublets pointant vers les sommets d'un tétraèdre dont le centre est occupé par l'atome de carbone. On parle de carbone tétragonal.
Exemple : Géométrie de la molécule d'ammoniac
La formule de Lewis de la molécule d'ammoniac est donnée ci-contre. Elle montre trois liaisons covalentes et un doublet non liant, soit quatre éléments à répartir dans l'espace.
Ces quatre doublets se répartissent donc en adoptant une géométrie tétraédrique.
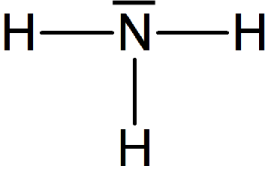
Les trois liaisons covalentes de la molécule d'ammoniac ne sont pas dans un même plan à cause de la présence du doublet non-liant sur l'atome d'azote.
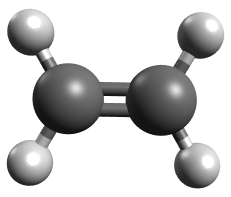
Exemple : Géométrie de la molécule d'éthylène
La formule de Lewis de la molécule d'éthylène est donnée ci-contre. Chaque atome de carbone a engagé trois liaisons covalentes dont une double et ne possède pas de doublet non liant.
La géométrie optimale permettant d'éloigner au maximum les trois liaisons autour d'un atome de carbone les fait pointer vers les sommets d'un triangle.
Ce type de carbone est dit trigonal, les atomes voisins de la double liaison sont tous dans le même plan.
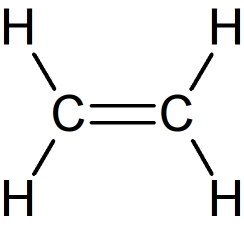
Contrairement à la liaison simple carbone-carbone qui autorise la libre rotation des groupes d'atomes autour de son axe, la liaison double entre atome de carbone bloque cette rotation. Sa géométrie est figée.
Ci-dessous, deux vues de la molécule illustrant le caractère plan de géométrie des liaisons voisines de la double liaison carbone-carbone.

Généralisation - La méthode VSEPR
On retient le principe suivant pour prévoir la géométrie d'une molécule lorsqu'on dispose de sa représentation de Lewis : les doublets, liants ou non-liants, se répartissent dans l'espace de façon à minimiser la répulsion électrostatique. Selon ce principe, c'est la présence de doublets non-liants qui conduit la molécule d'eau à être coudée et la molécule d'ammoniac à adopter une forme pyramidale.