Expression de la loi de Beer-Lambert
On a établi une relation de proportionnalité entre l'absorbance et la concentration, pour une longueur d'onde donnée et pour une espèce chimique donnée (les ions permanganate).
Pour une espèce chimique colorée quelconque, en concentration C dans une solution aqueuse, la loi de Beer-lambert s'exprime de la façon suivante :
Avec :
A l'absorbance de la solution.
\(\mathbf{\epsilon \left( \lambda \right)}\) le coefficient d'extinction molaire en \(\mathrm{L \cdot mol^{-1} \cdot cm^{-1}}\).
l, la longueur de solution traversée, en \(cm\).
C la concentration molaire de la solution en espèce chimique en \(\mathrm{mol \cdot L^{-1}}\).
Attention : Perte de la relation de proportionnalité
Pour des solutions trop concentrées, la relation de proportionnalité cesse d'être valable. On effectue donc l'étalonnage de l'appareil avec des solutions dont les concentrations ne sont pas trop éloignées de la concentration à mesurer.
Complément : Interprétation du coefficient d'extinction molaire
Le coefficient d'extinction molaire \(\epsilon \left(\lambda \right)\) est une fonction propre à chaque espèce chimique.
Cette fonction traduit les variations intrinsèques de l'absorbance en fonction de la longueur d'onde \(\lambda\) et elle permet de repérer les pics d'absorptions caractéristiques de l'espèce chimique étudiée.
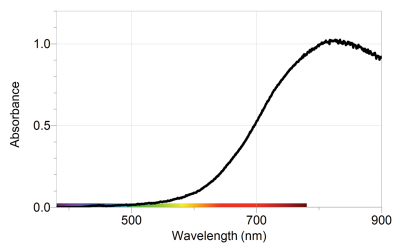
Les allures des deux spectres d'absorption présentés ci-dessous traduisent deux fonction \(\epsilon \left(\lambda \right)\) différentes.
Spectre d'absorption d'une solution aqueuse de diiode
Complément : Additivité des absorbances
Si on réalise une solution en mélangeant plusieurs espèces chimiques colorées, l'absorbance résultante est la somme des absorbances de chaque espèce :
\(A_\lambda^{totale}=A_1+A_2+A_3+...=\epsilon_1(\lambda) \times l \times C_1+\epsilon_2(\lambda) \times l \times C_2+\epsilon_3(\lambda) \times l \times C_3+...\)
Cette relation peut s’exprimer de la façon condensée suivante pour un mélange contenant n espèces chimiques : \(A_\lambda^{totale}=\displaystyle{\sum_{i=1}^n \epsilon_i(\lambda) \times l \times C_i}\).
Méthode : Exploitation en chimie
Lorsqu'on exploite dans un protocole concret de chimie la loi de Beer-lambert \(A=\epsilon \left( \lambda \right) \times l \times C\), des simplifications apparaissent :
Pour un spectrophotomètre donné, la longueur l de solution traversée est fixe. C'est une caractéristique de l'appareil utilisé.
Pour une espèce chimique donnée, et lorsqu'on fixe la longueur d'onde de travail \(\lambda\), \(\epsilon \left(\lambda \right)\) a une valeur constante, indépendante de la concentration de la solution.
Donc, le produit \(\epsilon \left(\lambda \right) \times l\) est constant.
On retrouve alors la proportionnalité entre l'absorbance et la concentration établie lors du TP sur la solution de Dakin : \(A=k \times C\).
k est une constante liée à l'appareil utilisé, à la longueur d'onde de travail et à l'espèce chimique étudiée.
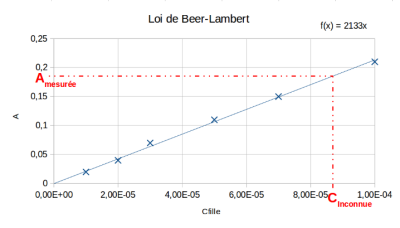
La connaissance de la relation de proportionnalité entre l'absorbance et la concentration permet une détermination quasi-immédiate, graphique ou par le calcul, d'une concentration inconnue par une mesure d'absorbance.
Ci-contre, on lit la concentration CInconnue sur le graphique ou on l'obtient par le calcul \(C_{Inconnue}=\dfrac{A_{Mesuree}}{2133}\).