Composition de la solution dans le ballon
La forte aspiration de l'eau dans le ballon traduit la dissolution complète du gaz HCl dans l'eau, créant une dépression et permettant à l'eau d'entrer dans le ballon.
L'indicateur coloré prend sa teinte acide, on en déduit donc que la dissolution du gaz HCl produit des ions oxonium H+ \(\mathbf{\left(H_3 O^+\right)}\).
Le précipité blanc en présence de nitrate d'argent met en évidence la formation d'ions chlorure Cl- lors de la dissolution.
En conclusion, on constate que la dissolution du chlorure d'hydrogène se traduit par la dissociation de la molécule de HCl. Lors de la rupture de la liaison covalente, l'atome de chlore emporte les deux électrons du doublet pour former un ion chlorure et l'atome d'hydrogène forme un ion H+.
Molécule d'eau et interaction électrostatique
L'expérience du filet d'eau dévié montre que les molécules d'eau, bien que neutres comme toute molécule, interagissent électriquement avec des objets chargés.
Définition : Électronégativité
Cette propriété caractérise la capacité d’un élément chimique à attirer à lui les électrons d’une liaison covalente. Plus l’électronégativité d’un élément chimique est grande, plus il a tendance à attirer les électrons des liaisons covalentes qu’il forme avec d’autres atomes. En d’autres termes, les électrons d’une liaison covalente établie entre deux atomes d’électronégativités différentes ont une probabilité de présence plus grande près de l’atome dont l’électronégativité est la plus élevée.
L'électronégativité est notée \(\chi\).
Électronégativités des atomes concernés
Question⚓
On trouve dans les données chimiques les électronégativités des éléments entrant en jeu dans cette dissolution :
\(\chi_H=2{,}20\)
\(\chi_O=3{,}44\)
\(\chi_{Cl}=3{,}16\)
Compte tenu de ces données, les électrons des liaisons covalentes sont-ils répartis uniformément entre les atomes impliqués dans les liaisons H-Cl et H-O de la molécule d'eau ?
Une molécule est polaire si elle contient des liaisons covalentes polarisées et si l'ensemble des charges négatives réduites en un point et l'ensemble des charges positives réduites en un point occupent des régions distinctes de manière permanente. En mathématique, on parle de barycentre des charges positives et de barycentre des charges négatives.
Les molécules d'eau et de chlorure d'hydrogène sont-elles polaires ?
Proposer une interprétation de l'expérience en exploitant l'interaction possible entre molécules polaires.
Solution⚓
1. Les électronégativités des atomes engagés dans les liaisons covalentes sont significativement différentes, donc ces liaisons sont polarisées.
Les électrons de la liaison H-Cl sont partiellement délocalisés vers l'atome de chlore, plus électronégatif que l'hydrogène.
Les électrons de la liaison H-O sont partiellement délocalisés vers l'atome d'oxygène, plus électronégatif que l'hydrogène.
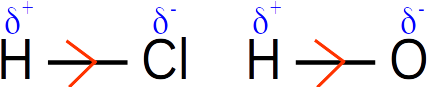
2. La molécule HCl est diatomique et la liaison covalente est polarisée. La molécule de chlorure d'hydrogène est donc polaire.

Pour déterminer si la molécule d'eau est polaire, il faut tenir compte de sa géométrie et prendre en considération qu'elle n'est pas linéaire. Si on réduit les charges positives et négatives à un équivalent unique, on constate alors que charges négatives et positives sont localisées dans des régions différentes de la molécule. La molécule d'eau est donc polaire.
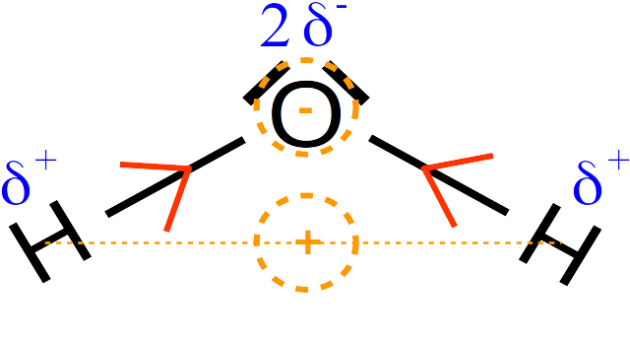
3. Si on revient à l'expérience observée, on peut dans un premier temps expliquer la très grande solubilité du chlorure d'hydrogène dans l'eau par l'interaction électrostatique existant entre ces deux molécules polaires.