Définition : Oxydant / Réducteur
En solution aqueuse, on définit un oxydant comme une espèce chimique susceptible de capter un ou plusieurs électrons. Un réducteur est défini comme une espèce chimique susceptible de céder un ou plusieurs électrons.
Deux espèces chimiques pour lesquelles un transfert d'électrons intervient lors de la transformation de l'une à l'autre constituent un couple oxydant-réducteur (parfois appelé couple redox).
Ce couple est toujours noté \(Ox/Red\), dans cet ordre.
Exemple :
Les ions cuivre II \(Cu^{2+}_{(aq)}\) et le cuivre métallique \(Cu_{(s)}\) constituent le couple oxydant réducteur \(Cu^{2+}_{(aq)}/Cu_{(s)}\). On peut mettre en évidence le transfert d'électrons permettant de passer d'une espèce chimique à l'autre : \(Cu^{2+}_{(aq)}+2e^- \rightarrow Cu_{(s)}\).
Définition : Oxydation et réduction
En solution aqueuse, une oxydation est définie comme une perte d'électrons et une réduction comme un gain d'électrons.
Lors d'une réaction d'oxydoréduction, l'oxydant subit une réduction et le réducteur subit une oxydation.
Méthode : Écrire l'équation d'une réaction d'oxydoréduction à partir des couples oxydant/réducteur
L'écriture d'une réaction d'oxydoréduction s'effectue en plusieurs temps et suit une méthode précise dont il faut respecter la chronologie pour éviter les erreurs.
On commence par écrire les demi-équations électroniques des deux couples concernés dans le sens réel de la transformation chimique observée.
Il faut ensuite combiner les deux demi-équations en mettant en jeu autant d'électrons libérés dans l'une que captés dans l'autre. Cela impose dans le cas général de multiplier les demi-équations par des entiers avant de les ajouter membre à membre.
Méthode : Équilibrer une demi-équation électronique
On suit scrupuleusement les étapes suivantes, dans cet ordre.
On équilibre dans un premier temps les éléments chimiques autres que l'hydrogène et l'oxygène.
On équilibre l'élément oxygène O en ajoutant autant de molécules d'eau que nécessaire dans le membre correct de la demi-équation.
En milieu acide, on équilibre l'élément hydrogène H en ajoutant des ions hydrogène H+ que nécessaire dans le membre correct de la demi-équation.
Enfin, on équilibre la charge électrique à l'aide d'électrons e- en nombre suffisant dans le membre correct de la demi-équation.
Si on est en milieu basique, on exécute les quatre étapes précédentes, puis on ajoute dans chaque membre de l'équation autant d'ions hydroxyde OH- qu'il y a d'ions H+ à neutraliser : un ion hydroxyde et un ion hydrogène réagissent pour former une molécule d'eau selon la réaction \(H^+_{(aq)}+OH^-_{(aq)}\rightarrow H_2O_{(l)}\)
Exemple : Demi-équation électronique d'un couple
On prend l'exemple du couple nitrate/monoxyde d'azote \(NO_{3(aq)}^-/NO_{(g)}\).
\(NO_{3(aq)}^- \rightarrow NO_{(g)}\)
L'élément azote N est équilibré, donc on ne fait rien à cette étape.
On équilibre l'oxygène à l'aide de molécules d'eau :
\(NO_{3(aq)}^- \rightarrow NO_{(g)} + 2H_2O_{(l)}\)
On équilibre l'élément hydrogène en milieu acide avec des ions H+ :
\(NO_{3(aq)}^- + 4H^+_{(aq)} \rightarrow NO_{(g)} + 2H_2O_{(l)}\)
Il reste à équilibrer la charge électrique avec des électrons :
\(NO_{3(aq)}^- + 4H^+_{(aq)}+3e^- \rightarrow NO_{(g)} + 2H_2O_{(l)}\)
En milieu basique, on neutralise les quatre ions H+ en ajoutant de part et d'autre quatre ions hydroxyde OH-.
\(NO_{3(aq)}^- + \underbrace{4H^+_{(aq)}+4OH^-_{(aq)}}_{4H_2O_{(l)}}+3e^- \rightarrow NO_{(g)} + 2H_2O_{(l)}+4OH^-_{(aq)}\)
Ce qui peut se simplifier de la façon suivante :
\(NO_{3(aq)}^- + 2H_2O_{(l)}+3e^- \rightarrow NO_{(g)} +4OH^-_{(aq)}\)
Méthode : Écrire l'équation bilan d'une réaction d'oxydoréduction
On établit l'équation bilan en combinant membre à membre deux demi-équations :
en les écrivant dans des sens permettant de faire réagir l'oxydant d'un couple avec le réducteur d'un autre couple ;
en s'assurant de mettre en jeu autant d'électrons du côté des réactifs et des produits, de façon à les éliminer.
Exemple dans le cas de la réaction entre les ions argent et le cuivre solide avec les demi-équations écrites dans le sens effectif de la réaction :
\(Ag^+_{(aq)} + e^- \rightarrow Ag_{(s)}\)
\(Cu_{(s)} \rightarrow Cu^{2+}_{(aq)}+2e^-\)
Pour obtenir l'équation bilan de la réaction, on combine membre à membre ces deux demi-équations de façon à éliminer les électrons mis en jeux de part et d'autre. On multiplie donc la première demi-équation par 2.
Et on obtient finalement : \(Cu_{(s)} + 2\ Ag^+_{(aq)} \rightarrow Cu^{2+}_{(aq)} + 2\ Ag_{(s)}\).
Complément : Prévoir le sens de la réaction entre deux couples oxydant/réducteur (hors programme)
Ce point n'est pas explicitement au programme.
Si on considère deux couples oxydant/réducteur, il y a à priori deux réactions possibles.
La réaction qui a effectivement lieu est celle qui fait réagir l'oxydant le plus fort avec le réducteur le plus fort.
On trouve dans les données chimiques les potentiels d'oxydoréduction standards de tous les couples connus.
Plus le potentiel standard d'un couple est élevé, plus l'oxydant du couple est fort ;
plus le potentiel standard d'un couple est faible, plus le réducteur du couple est fort.
Dans l'illustration ci-contre, la réaction qui se produit effectivement est celle entre l'oxydant du premier couple (OX 1) avec le réducteur du deuxième (Red 2).
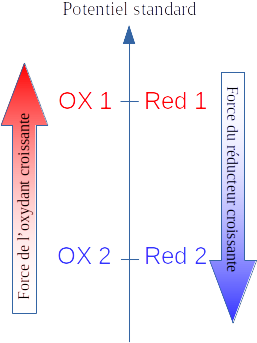
Si on reprend les réactions observées lors de la première séance de TP su ce thème, on a les potentiels standards suivants :
\(E^0 \left(Ag^+/Ag\right)=0{,}80\ \mathrm V\) ;
\(E^0 \left(Cu^{2+}/Cu\right)=0{,}34\ \mathrm V\) ;
\(E^0 \left(Zn^{2+}/Zn\right)=-0{,}76\ \mathrm V\).
D'après ces valeurs, les ions argent sont un oxydant plus fort que les ions cuivre et le cuivre un réducteur plus fort que l'argent : on a bien observé une réaction entre les ions argent et le cuivre solide (arbre de Diane).
De même, les ions cuivre sont un oxydant plus fort que les ions zinc et le zinc est un réducteur plus fort que le cuivre : on a bien observé une réaction entre les ions cuivre et le zinc et aucune réaction entre le cuivre et les ions zinc.