Expérience préliminaire - Le cuivre et le zinc
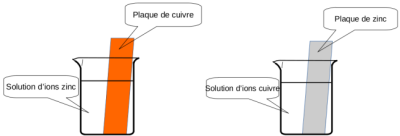
On constitue deux béchers de la façon suivante :
une lame de cuivre dans une solution contenant des ions zinc \(\mathrm{Zn}^{2+}\) ;
une lame de zinc dans une solution contenant des ions cuivre \(\mathrm{Cu}^{2+}\).
Aucune réaction n'est observable entre le cuivre et les ions zinc.
Dans le deuxième bécher, une réaction est observable : un dépôt se forme sur la plaque de zinc, d'abord noir puis des paillettes de cuivre finissent par être observables.
La seule réaction observable est donc : \(\mathrm{Zn}_{(s)}+\mathrm{Cu}^{2+}_{(aq)}\rightarrow \mathrm{Zn}^{2+}_{(aq)} + \mathrm{Cu}_{(s)}\)
Le zinc cède donc des électrons selon la demi-équation : \(\mathrm{Zn}_{(s)} \rightarrow \mathrm{Zn}^{2+}_{(aq)} + 2\mathrm{e}^-\).
Le cuivre capte donc des électrons selon la demi-équation : \(\mathrm{Cu}^{2+}_{(aq)}+ 2\mathrm{e}^- \rightarrow \mathrm{Cu}_{(s)}\).
La réaction globale consiste donc en un transfert d'électrons cédés par la zinc solide et captés par les ions cuivre.
Ce transfert s'effectue à l'interface entre la solution et la plaque de cuivre : c'est un transfert direct d'électrons.
Un générateur électrochimique⚓
Exploiter une réaction d'oxydoréduction pour constituer une pile
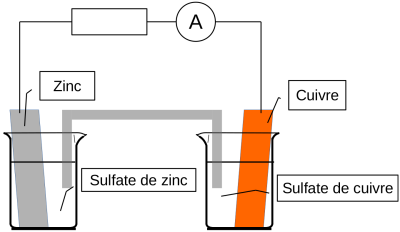
On modifie le dispositif expérimental pour faire en sorte que l'échange d'électrons s'effectue de manière indirecte, par l'intermédiaire d'un circuit électrique (constitué ici d'une résistance).
On sépare le cuivre et le zinc en deux demi-piles, reliées par un pont salin (électrolyte[*] constitué d'une solution ionique).
Lorsqu'on ferme le circuit, on mesure une intensité non nulle. Dans la séance de travaux pratiques, avec une résistance \(R=100\ \Omega\), on a obtenu \(I \simeq 0{,}25\ \mathrm{mA}\).
Cette intensité, même faible montre que le dispositif réalisé est bien un générateur.
Circulation des porteurs de charges⚓
Détermination de la polarité de la pile constituée et circulation des porteurs de charges
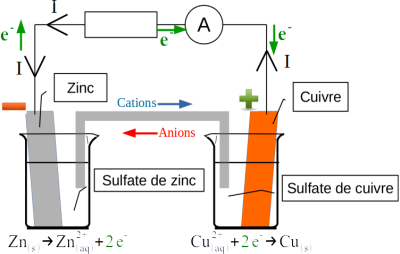
En confrontant le signe de l'intensité mesurée au sens de branchement de l'ampèremètre dans le circuit, on détermine le sens de circulation du courant à l'extérieur de la pile (fléché I sur les fils).
Par convention, le courant électrique circule de la borne positive vers la borne négative du générateur dans le circuit électrique : l'électrode de cuivre constitue donc la borne positive de la pile.
Dans les fils électriques, les porteurs de charges sont les électrons. Ils circulent en sens inverse du courant électrique.
À l'intérieur de la pile, entre les deux demi-piles, la continuité du circuit doit être assurée. Les porteurs de charge dans les solutions sont les cations (+) et les anions (-) : les cations circulent dans le même sens que le courant électrique et les anions dans le même sens que les électrons.
On fait figurer les demi-équations se produisant dans chaque demi-pile. L'équation bilan de la réaction de fonctionnement de la pile est la même que lors du transfert direct d'électrons.